Las claves de los «detectives» del cáncer hereditario: «Saber que tienes una mutación puede salvarte la vida»

ENFERMEDADES
Analizamos cuáles son los tumores hereditarios más frecuentes y qué medidas de prevención existen en aquellos casos en los que la persona es portadora de una mutación, pero no ha desarrollado la enfermedad
23 jun 2025 . Actualizado a las 19:03 h.«¿Qué hago si he heredado una mutación que aumenta el riesgo de cáncer?». Esa es la pregunta a la que intentan responder los «detectives» del cáncer familiar. Buscar en árboles genealógicos a integrantes que pueden haber heredado mutaciones que aumentan el riesgo de cáncer. La unidad de Cáncer Familiar del Centro Nacional de Investigaciones Oncológicas (CNIO) estudia cerca de 600 casos al año. Más de una cuarta parte son personas sanas que tienen a un familiar con cáncer, en quien se ha identificado una alteración genética que aumenta las probabilidades.
María Currás, jefa de esta unidad clínica, matiza términos en los que suele existir confusión antes de entrar en materia. «Hablamos de cáncer familiar cuando existe una agregación de casos de tumores en el linaje, pero no se ha identificado una mutación que lo cause. El tipo hereditario cumple esos criterios, pero además conocemos la causa genética que le ha dado lugar». Se calcula que del 70 al 80 % de los cánceres son esporádicos, causados por factores ambientales, hábitos de vida y envejecimiento. De un 15 a un 20 % de los casos se observa agregación familiar de uno o varios tipos concretos de cánceres y del 5 al 10 % son de susceptibilidad genética heredada.


Diferenciando mutaciones genéticas de las del tumor
«El cáncer no se hereda, sino una alteración genética en un gen concreto que hace que sea más probable que se desarrolle un tipo de cáncer. Esas alteraciones se pueden transmitir a los hijos si están presentes en el óvulo o en el espermatozoide. En estos casos, la mutación está en línea germinal», apunta Ana Beatriz Sánchez, coordinadora de la sección de la Sociedad Española de Oncología Médica (SEOM) de Cáncer Familiar y Hereditario. Según sus palabras, se conocen unos 200 genes que pueden causar predisposición a cáncer, «con gran variabilidad de riesgo: alto, moderado y medio a bajo; siendo la mayoría muy poco frecuentes».

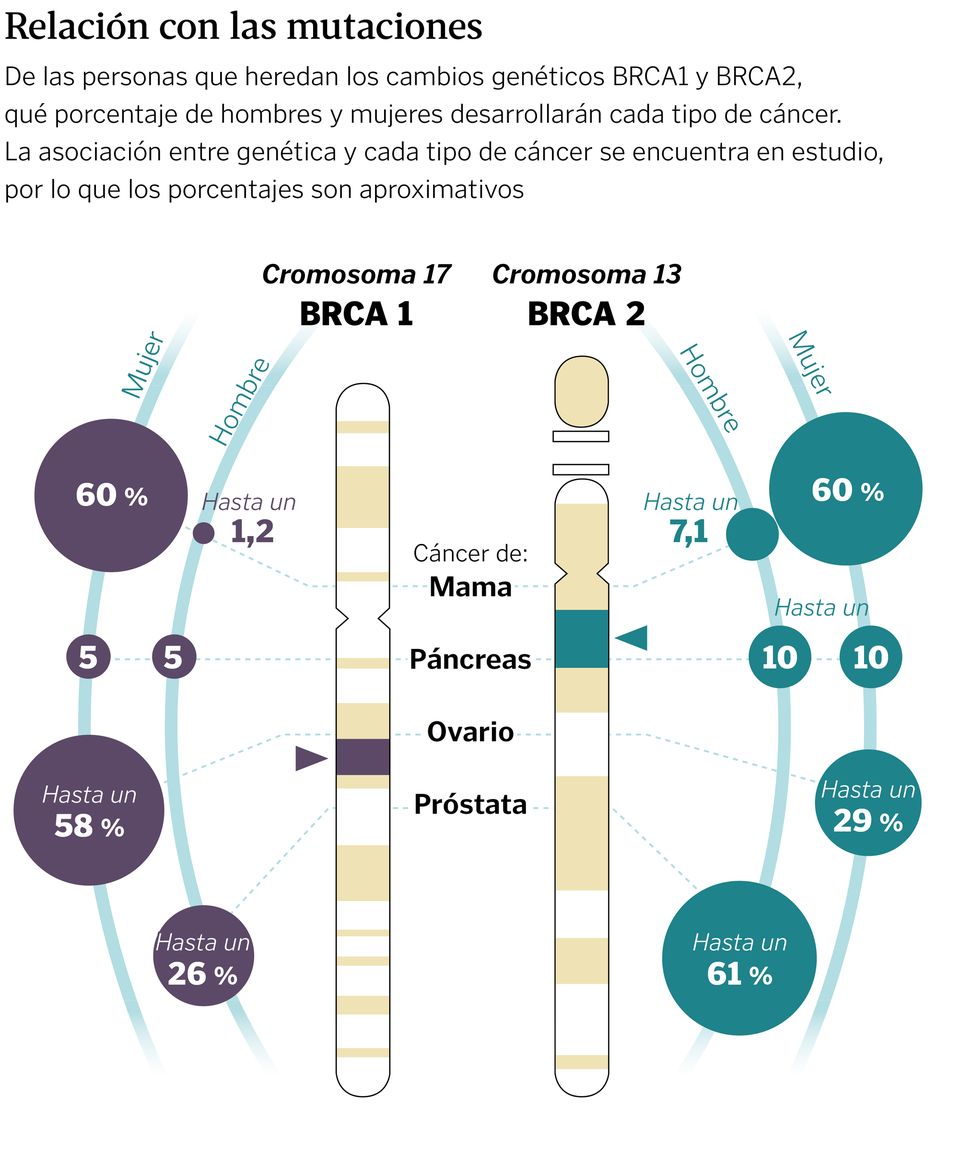
Jesús Bañales, investigador y catedrático de Ciencias de la Universidad de Navarra, expone que «genes como BRCA1 y BRCA2 son supresores tumorales, es decir, ayudan a controlar el crecimiento celular y prevenir la formación de tumores; actúan como un freno». Cuando existe una mutación en los mismos, este freno puede dejar de funcionar. «En consecuencia, personas que tienen estas mutaciones ven cómo aumenta su riesgo de diferentes tumores epiteliales como el de mama, ovario, biliar, etcétera», amplía el experto.
Así, también es necesario diferenciar entre estas mutaciones genéticas que se heredan y pueden aumentar el riesgo de cáncer, de las adquiridas que se desarrollan durante la vida de una persona. «El inicio del cáncer se debe a daños sucesivos en el material genético o ADN de una célula, producido por sustancias químicas, radiaciones, infecciones, tipo de alimentación, alteraciones del metabolismo o incluso el envejecimiento. Dan lugar a mutaciones que facilitan la multiplicación celular descontrolada y posterior invasión de tejidos vecinos o a distancia». Conocer las mutaciones genéticas que tiene un cáncer es fundamental: «Permite individualizar el tratamiento para obtener mejores resultados de curación o remisión», añade.
Una persona puede ser considerada de alto riesgo si se confirma que es portadora de una variante patogénica en un gen de alto riesgo asociado a un determinado tipo de cáncer.
- Para cáncer de mama en los genes: BRCA1, BRCA2, TP53 (síndrome de Li-Fraumeni), PTEN (síndrome de Cowden), STK11 (síndrome de Peutz-Jeghers) o PALB2; otros genes de moderada penetrancia: ATM, CHEK2 y NBN.
- Para cáncer de ovario en los genes BRCA1 y BRCA2.
- Para cáncer de colon en los genes MLH1, MSH2, APC.
- Para cáncer de endometrio en los genes MLH1, MSH2, MSH6.
- Para paragangliomas/feocromocitomas en los genes SDHB, SDHD, RET, VHL.
Fuente: SEOM
Los cánceres con mayor predisposición genética en nuestro país
«En cifras absolutas, lo más frecuente es en cáncer de mama. Se estima que del 5 al 10 % se deben a predisposición genética», sostiene Sánchez. Teniendo en cuenta que para este 2025 se estima que se diagnosticarán 37.682 casos de cáncer de mama —según el informe Las cifras del cáncer en España, elaborado por la SEOM en colaboración con la Red Española de Registros de Cáncer—, por regla de tres de 1.884 a 3.768 serán por predisposición genética.
Le sigue el cáncer colorrectal. «Se estiman 44.573 nuevos casos para 2025, de los cuales el 5 % aproximadamente, 2.228 casos, se deberán a predisposición genética», indica la oncóloga. Además, «un 40 % de los paragangliomas y feocromocitomas se deben a predisposición genética hereditaria, pero su incidencia es muy baja, de 0,66 casos por cada 100.000 habitantes, por lo que en cifras absolutas son poco frecuentes».

Cuándo se sospecha alto riesgo hereditario
«Se debería sospechar que hay posibilidad de un cáncer hereditario si el tumor aparece a una edad joven. Por ejemplo, cáncer de colon con menos de 50 o 55 años, o de mama con menos de 40», sostiene Currás. También si desarrolla tumores múltiples o «si el paciente tiene familiares que han tenido el mismo tumor o los que llamamos relacionados: sabemos que hay grupos de tumores que si van juntos nos orientan hacia un síndrome particular, una causa común hereditaria», añade. Por ejemplo, el síndrome de Cáncer de Mama y Ovario Hereditarios (CMOH), los síndromes de Lynch y de Cowden, la Poliposis Adenomatosa Familiar (PAF), la neoplasia endocrina Múltiple o la neurofibromatosis.
Así, se lleva a cabo un estudio genético cuando la persona cumple características que hacen sospechar a la comunidad médica que es portadora de una alteración genética de susceptibilidad al cáncer. «Los criterios para hacerlo varían según el tipo de tumor y la edad de diagnóstico, si hay dos o más casos en familiares de primer grado, o cuando ya hay un diagnóstico genético familiar confirmado y es probable que comparta la característica genética», asegura la oncóloga.
Con todo, también es posible realizarlo para buscar oportunidades de tratamientos específicos y personalizados mediante tratamientos dirigidos. «Hay tumores que, por sí solos, como el de ovario o de páncreas, es indicación de hacer estudio genético independientemente de la edad», dice Currás. También sucede en algunos casos de mama.
Según la SEOM, toda persona que sepa que en su familia existen varios casos de cáncer debería acudir a su médico de atención primaria para una primera valoración. Si este considera que los datos sugieren un trastorno hereditario, deberá remitirle a la unidad de consejo genético más cercana. En España, existen más de cien. En Galicia, hay nueve: Fundación Pública Galega de Medicina Xenómica, Complexo Hospitalario Universitario de A Coruña (Chuac), Hospital Materno Infantil Teresa Herrera (A Coruña), Hospital Arquitecto Mardice (Ferrol), Hospital Clínico Universitario de Santiago (CHUS), Hospital Lucus Augusti (Lugo), Complexo Hospitalario Universitario de Pontevedra (CHUP), Complexo Hospitalario Universitario de Ourense (CHUO) y Complejo Hospitalario Universitario de Vigo (Chuvi).
¿Y si el test genético sale positivo?
«En las personas con susceptibilidad genética confirmada, dependiendo del gen alterado hay protocolos diferentes», avanza la oncóloga. «Por ejemplo, para BRCA1 y BRCA2 en mujer se recomienda resonancia magnética mamaria anual a partir de los 25 a los 30 años junto con mamografías anualmente a partir de los 40 y exploración ginecológica mediante ecografía trnavaginal a partir de los 30 años hasta el momento de la decisión de cirugía preventiva (que no debe hacerse nunca antes de los 35 a 40 años)», explica. En el caso de los hombres, la doctora indica que el riesgo para BRCA 2 es de cáncer de próstata. «Ahí se recomienda la determinación del PSA en sangre y la realización de exploración prostática, anualmente a partir de los 40 años».
Más allá de esos dos genes, que son los más frecuentes, la doctora menciona el gen CHEK2 de moderado riesgo de cáncer de mama en mujer: «Se recomiendan mamografías anualmente, con o sin resonancia magnética mamaria, a partir de los 40 años». Así como para el MLH1 y MSH2, «que se recomienda cribado de cáncer de colon mediante colonoscopia cada uno o dos años a partir de los 25». Y remarca: «Los protocolos son diferentes según el gen alterado y los riesgos asociados».
Cuando existen antecedentes fuertes, pero no se identifica alteración genética responsable «no se puede decir que es ‘’negativo’’; son casos para volver a estudiar según los avances de los conocimientos». Y si se tiene una alteración que has heredado, «esto te confiere más riesgo que la población general para poder desarrollar un tumor, pero eso no quiere decir que sí o sí vaya a suceder», matiza Currás, que tambíén subraya: «Saber que tienes una mutación puede salvarte la vida».

Medidas de prevención: del diagnóstico precoz a la cirugía profiláctica
La primera medida de prevención, en realidad, debería ser llevada a cabo por toda la población. «Seguir estilos de vida sanos y evitar factores de riesgo: alimentación, ejercicio físico y evitar carcinógenos», recomienda Sánchez. Entre estos últimos se encuentra el tabaco, el exceso de radiaciones ultravioletas, padecer obesidad y consumir productos ultra procesados.
A nivel clínico se establecen recomendaciones de diagnóstico precoz, como la mamografía, la resonancia magnética mamaria o la colonoscopia; según el protocolo para cada tipo de alteración genética. «También existen cirugías reductoras de riesgo como la extirpación de glándulas mamarias, de ovarios y trompas uterinas, de colon, etcétera», añade.
La intervención profiláctica tiene aplicación en Polimatosis Adenomatosa Familiar (PAF), Cáncer de Mama y Ovario Hereditarios (CMOH) y en menor medida en el síndrome de Lynch. «Se aconseja en casos en los que el riesgo de desarrollar el tumor es del 50 % o superior. Antes era más frecuente. Ahora, cada vez más, se intenta ser lo más conservador posible», amplía Currás. Un ejemplo es la extirpación de la vesícula que se daba en aquellos individuos con riesgo de padecer cáncer de vías biliares. «Aunque es una cirugía segura, todo tiene un riesgo. Se puede hacer una vida normal sin ella, pero ahora solo se quita en circunstancias muy concretas, como cuando ya se da inflamación y dolor», indica Bañales.
En los genes BRCA1 y BRCA2 la extirpación de ovarios y trompas uterinas reduce el riesgo de cáncer de ovario de un 95 a un 97 %. «Se recomienda realizarlo de los 40 a los 45 años de edad, una vez completado el deseo de maternidad», indica Sánchez. La situación es similar en el caso de las glándulas mamarias. «Su extirpación reduce el riesgo de cáncer de mama en un 90 a un 95 % y, aunque no hay indicación de edad límite, por encima de los 55 años el beneficio esperado es menor», añade. Además, a día de hoy se llevan a cabo técnicas mucho menos invasivas para reducir el impacto físico y psicológico que puede darse en las pacientes.
Para el gen APC que se relaciona con la poliposis adenomatosa familiar (PAF), causante de menos de 1 % de los cánceres de colon y recto, «la extirpación total reduce casi al 100 % el riesgo de desarrollar el tumor, pero tinee consecuencias y secuelas con merma de calidad importante», asegura la oncóloga de la SEOM. «Por ello, las indicaciones de cirugías preventivas se valorarán habitualmente por un comité de expertos y se debe asesorar adecuadamente a la persona para que tome la decisión».
Los retos
La cartera común de servicios del Sistema Nacional de Salud se ha actualizado recientemente con un catálogo de mínimos de pribeas genéticas y genómicas que debe ser cumplido por todas las comunidades autónomas. «Es el primer paso para conseguir la equidad asistencial para todos los ciudadanos», sostiene Sánchez. Además, lamenta que a día de hoy «no tenemos registros nacionales oficiales (de las administraciones) de cáncer hereditario que nos permitan conocer la realidad de este problema y así poder planificar mejor la asisencia sanitaria».
A nivel de investigación, Currás, explica: «De todas las variantes que nos podemos llegar a encontrar, hay unas que llamamos de significado desconocido. Son sobre las que no tenemos suficiente información a nivel de predictores, función de proteína o incluso artículos publicados para saber si es de riesgo o no. Eso al paciente le geenera intranquilidad, porque le piedes decir que has encontrado una mutación, pero una variante que no sabes exactamente qué es». Si bien la especialista recalca la sencillez y efectividad de un proceso que resulta muy esclarecedor para este pacientes y familiares: «No es más que un análisis de sangre y una consulta en la que se preguntan los antecedentes familiares, y es muy informativo para ellos».
Alla sufre cáncer de mama hereditario: «Todas las mujeres de la familia de mi madre lo habían padecido»

El estudio genético reveló que es portadora del BRCA1, por lo que se tendrá que extirpar mamas, ovarios y trompas uterinas para reducir el riesgo de recidiva y de padecer cáncer de ovarios
«Tengo 49 y hace un año me han descubierto un cáncer de mama», cuenta Alla. Su ginecólogo la tenía «fichada» desde hace un tiempo porque tenía antecedentes. Ella vive desde hace más de dos décadas en nuestro país, pero el resto de su familia reside en Ucrania. Recuerda la cita con el genetista en la que le pidieron hacer un árbol genealógico. «Me llevé una lista y esta impresiona. La familia de mi padre es muy pequeña y había mucho cáncer, pero no había de mama. Pero por parte de mi madre, todas las mujeres de su generación y las de mi abuelo materno lo padecían, de pecho», lamenta.
Por si todo esto fuese poco, su marido también había sufrido un tumor en el pulmón hace cuatro años. Eso sí, con muy buen pronóstico y «cogido a tiempo», solo necesitó cirugía. No fue el caso de Alla. Su periplo es un poco más complejo. A día de hoy lucha contra los efectos secundarios de la hormonoterapia y está pendiente de fechas para extirpación de mamas, ovarios y trompas como medidas preventivas.
«Por antecedentes sabía que iba a pasar, pero desconocía cuándo», dice. «Para mí la gran sorpresa fue tener que someterme a quimioterapia porque en principio el médico me dijo que solo iba haber operación y radioterapia». Sin embargo, el «oncotype» (prueba que analiza la actividad de 21 genes para identificar riesgo de recurrencia) reveló un valor muy alto de recidiva. «Ahí sí que me llevé un disgusto». Pero la llevó muy bien: «Anímicamente y físicamente. Siempre digo que ojalá otros la pasaran como yo».
Cirugía, quimio, radio y ahora, hormonoterapia. «Una pastilla durante cinco años, diaria. Y con lo pequeñita que es, la llevo muy mal». Después de unos meses tomándola, confiesa que le duele todo el cuerpo. «Es como una especie de artrosis. Tengo el brazo atado porque si no, me resulta imposible. Las manos las tengo inflamadas. Me duelen mucho las rodillas. No puedo hacer nada», narra.
Eso fue lo que la llevó a llamar a la puerta de Ainhoa Carrasco, psicóloga en la Asociación Española Contra el Cáncer (AECC). «No podía luchar más. Tenía pensamientos suicidas. Quería quitarme la vida. Pero me gustó lo que me dijo ese día —dice, girándose hacia ella—: ‘‘No deseas acabar con tu vida, sino con el dolor''. Fue ahí cuando me di cuenta de que tenía toda la razón».
En este punto de la conversación, Carrasco interviene para hacer una apreciación: «El tratamiento hormonal es muy desconocido. Es la última parte y la gente suele pensar que la paciente ya se encuentra bien, cuando pueden estar fatal, como ella». Alla reconoce que «cuesta creerlo porque físicamente se te ve muy bien», señalando su pelo incipiente, «pero me preocupa porque no sé si este dolor va a mejorar o empeorar».
La atención que brinda la Asociación Española Contra el Cáncer (AECC) es totalmente gratuita. El teléfono de contacto es 900 100 036, está disponible las 24 horas y los 365 días del año.
Portadora del BRCA1
Hace un mes llegó el resultado del test genético. Es portadora del BRCA1. Según la Sociedad Española de Oncología Médica (SEOM), aproximadamente un 7 % de los cánceres de mama y de un 11 a un 15 % de los cánceres de ovario se consideran hereditarios, debido a una mutación genética heredada de uno de los padres. BRCA1 y BRCA2 son los genes que se asocian con una mayor proporción de casos al cáncer de mama y ovario hereditario.
Alla tiene que someterse a la extirpación de mamas, ovarios y trompas de Falopio para reducir el riesgo de recidiva y de padecer cáncer de ovarios. «No me lo esperaba, pero cuando me lo dijeron me acordé de mis dos tías, una de ellas segunda, que tuvieron cáncer de pecho y a los cinco años, de ovarios. Por eso dije: ‘‘Pues adelante''».
Dice afrontarlo con sentimientos contradictorios. «Por un lado, otra cirugía más, o las que sean. Sé que el posoperatorio de pecho puede ser duro. Pero también me da seguridad quitarme ese tejido, para seguir adelante». Alla incluso bromea con la situación: «No me da miedo porque siempre digo que voy a vivir una segunda juventud (ríe)».

Carolina ha sufrido cáncer de mama y se ha sometido a cirugía profiláctica: «Estoy pasando el duelo por la extracción de ovarios y trompas»

La coruñesa es portadora de la mutación BRCA2 y, después de pasar tres veces por quirófano, es probable que tenga que entrar una cuarta
Carolina Pan lleva tres años y medio en remisión completa. En el 2021 recibió el diagnóstico: cáncer de mama triple negativo, pero ahora mismo «mi cuerpo está libre de cáncer». Sin embargo, confiesa que en el fondo, está triste. «Estoy viviendo algo que creo que no me tocaba». Desde hace unos meses sufre los efectos de una menopausia precoz con 39 años por la extirpación de ovarios y trompas. «La llevo fatal porque mi cuerpo está inflamado». Ruega a la suerte para no entrar en quirófano en este 2025, porque el año pasado pasó por esa puertas dos veces. Pero en un momento u otro, tendrá que hacerlo por unos dolores que la acompañan a diario a raíz de sus prótesis. Con todo, exclama: «Solo tengo palabras de agradecimiento al equipo médico, porque me ha salvado la vida».
En esa consulta en la que su oncóloga pone nombre y apellidos a su cáncer, «me dice que en la mayoría de casos el triple negativo viene de una mutación genética y que iban a aprovechar para hacerme el test mientras estaba en quimioterapia porque nos podía ayudar a saber cuáles iban a ser los siguientes pasos». Si no se revelaba una mutación, el siguiente paso sería radioterapia. En caso contrario, antes sería necesaria una mastectomía. «Salió que era portadora de la BRCA2 y CHEK2, pero esta última la desconocen más».
El gen CHEK2 es otro de los genes identificados que aumenta el riesgo de cáncer de mama. En un estudio que no detectó mutaciones en BRCA1 y 2 en mujeres con una fuerte historia familiar de cáncer de mama u ovario se detectó en el 5 % de estas. El riesgo acumulado de cáncer de mama en mujeres con mutación de CHEK2 e historia familiar de cáncer de mama se ha estimado entre el 28 y el 37 %, siendo mayor en mujeres con antecedentes de cáncer de mama familiar.
Fuente: Sociedad Española de Oncología Médica (SEOM)
Con esos resultados, le preguntaron a sus progenitores si ellos querían hacerse un test y aceptaron. «En la familia de mi padre no hay nada de cáncer, pero en la de mi madre, un montón. Pero contra todo pronóstico, el que salió mutado es mi padre», explica. Carolina solo vivió el cáncer de colón y de próstata de su abuelo, pero conocía el historial familiar. Y reconoce que, en algún momento, sí llegó a pensar que era probable que a ella le tocase. De hecho, aunque la mutación venga de su padre, «mi oncóloga también me ha dicho que tendré que vigilarme el colon por los antecedentes».
La primera vez que entró en quirófano fue en el 2021, para una tumorectomía. La segunda, para una mastectomía y la tercera y más reciente, para una extirpación de los ovarios y las trompas de Falopio hace siete meses. «El día antes de la cirugía solo pensaba en la pena que me daba, porque al final me están quitando algo que está bien». Pero esa emoción se mezcló con el alivio, cuando ya finalizada la intervención le trasladaron que le habían encontrado un quiste en una de las trompas. «Era benigno, pero fíjate cómo es mi cuerpo con la mutación genética que ya estaba creando algo».

Además, la coruñesa cuenta una anécdota: «El triple negativo es un tumor de mama no hormonal y, cuando acabas el proceso, según la edad que tengas, ya te dicen que la regla te puede venir con normalidad o sufrir menopausia». En su caso, esta volvió a los seis meses de la quimio «y aunque ya en el último mes previo a la intervención estaba en perimenopausia, ese día, antes de entrar en quirófano, me bajó la regla. Vino a despedirse», asegura.
El posoperatorio fue sencillo, gracias a una intervención laparoscópica: «A los tres días ya me levantaba como si nada». Pero lamenta unos dolores crónicos que padece desde la mastectomía que la obligan a entrar al quirófano una cuarta vez. «Cuando me pusieron las prótesis estaba muy hinchada por la quimio y se me puso un pecho que en aquel momento era adecuado, pero ahora es demasiado. Ahora necesito que mi cuerpo se regule de la menopausia y me lo tengo que pensar, pero si es necesario, me las quito y me quedo sin pecho».